
По роду своей деятельности много езжу по разным медучреждениям, общаюсь со специалистами УЗД. При инструктаже по работе на УЗ аппарате всегда возникает вопрос, как правильно обрабатывать датчики?
Проблема действительно актуальна, существует реальный риск инфекционных осложнений при проведении УЗИ, особенно при внутриполостных и инвазивных УЗИ (1-3).
Для начала давайте обратимся к официальным регламентирующим документам РФ.
В настоящее время действуют Санитарно-эпидемиологические правила и нормативы СанПиН 2.1.3.2630-10 “Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность” (утв. постановлением Главного государственного санитарного врача РФ от 8 мая 2010 г. № 58). Там имеется п 10.14.3: Размещение, оборудование кабинетов ультразвуковой диагностики должны соответствовать гигиеническим требованиям к условиям труда медицинских работников, выполняющих ультразвуковые исследования.
Эти требования (принятые в 2007г, там много полезного для повседневной работы врача УЗД) уже публиковались (4). В этих «требованиях» есть такой пункт: 6.7. Очистку и дезинфицирование датчиков следует проводить после каждого обследования по методике и с использованием средств, рекомендованных в руководстве по эксплуатации оборудования. Внутриполостные исследования должны проводиться с обязательным использованием одноразовых защитных оболочек для датчиков.
Также непосредственно в вышеуказанном СанПине нашел п. 2.5 Изделия медицинского назначения после применения подлежат дезинфекции независимо от дальнейшего их использования (изделия однократного и многократного применения). Дезинфекцию можно проводить физическими и химическими методами. Выбор метода зависит от особенностей изделия и его назначения.
Никаких других упоминаний об обработке именно датчиков УЗ аппаратуры я в официальных документах не нашел (если кто знает – прошу сообщить!). Отсюда вывод – действовать по инструкции производителя УЗ сканера.
Многие коллеги ленятся читать инструкции (увы, но все не без греха), инструкций нередко нет или нет перевода на русский язык, инструкция переведена неадекватно (достаточно часто), раздел по обработке датчиков запрятан где-то в глубине и т.п. Я попытался суммировать свои познания из инструкций к УЗ приборам разных производителей, они в целом соответствуют официальному Руководству AIUM (Американского Института Ультразвука в Медицине) по очистке и подготовке УЗ датчиков между пациентами (5).
Ниже расскажу, как в идеале нужно обрабатывать датчики для рутинных исследований (контакт с неповрежденной кожей пациента) и внутриполостые датчики. Не касаюсь чреспищеводных, биопсийных, интраоперационных и т.п. датчиков. Естественно, все изложенное относится к датчикам без дефектов и повреждений акустической линзы, корпуса, стыков, кабеля, разъема и т.п.
В целом в зависимости от уровня контакта (соответственно риска инфекционных осложнений) датчика выделяют три уровня обработки.
| Классификация уровня | Определение | Уровень дезинфекции |
| Некритический | Датчик контактирует с неповрежденной кожей | Поверхностная дезинфекция |
| Полукритический | Датчик контактирует со слизистыми оболочками (внутриполостные исследования). Использование презервативов | Глубокая дезинфекция |
| Критический | Датчик непосредственно контактирует с внутренними органами и тканями (интраоперационное применение) | Стерилизация |
Как это должно быть реализовано пошагово?
1) Предварительная очистка.
Датчик следует очищать после каждого пациента а) или с помощью воды и нейтрального моющего средства или б) с помощью влажных салфеток и спреев, содержащих четвертичные аммониевые соединения (одно из средств для поверхностной дезинфекции см. ниже).
Для варианта а) если датчик водоустойчив (см инструкцию!) его нужно отсоединить от аппарата, под струёй воды удалить остатки геля и других загрязнений (Некоторые производители рекомендуют предварительное замачивание в растворах энзимов для растворения органических остатков).
Используйте марлевую салфетку или другую мягкую ткань и небольшое количество мягким неабразивного жидкого моющего средства (бытовые средства для мытья посуды идеально подходит), чтобы тщательно очистить датчик, но без избыточного усилия. Можно использовать мягкую щетку для очистки щелей и изгибов на корпусе датчика (в зависимости от конструкции датчика). Затем датчик споласкивают под струей воды и протирают сухой мягкой тканью или бумажными полотенцами.
У некоторых производителей датчики не являются водоустойчивыми (см инструкцию!), очистку производят влажной мягкой тканью. Рекомендуется также на этом этапе провести осмотр акустической линзы (рабочей поверхности), корпуса и кабеля датчика. Все манипуляции проводить максимально аккуратно, чтобы не повредить датчик.
Датчики («водоустойчивые») некоторых производителей можно замочить в ферментном растворе или для глубокой дезинфекции вот так (разъем не водоустойчив всегда!):
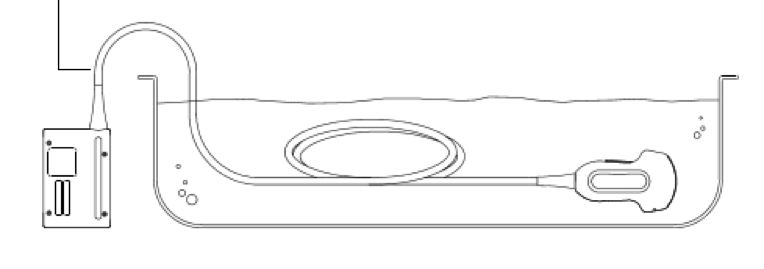
А некоторых вот так (см. инструкцию!)
2) Очищенные датчики, контактирующие с неповрежденной кожей, должны подвергаться поверхностной дезинфекции путем протирки влажными салфетками или обработки спреем. После протирки/обработки выдержать датчик 30 сек при бактериальных инфекциях (кроме возбудителей туберкулеза); 3 мин – при туберкулезной, вирусных и грибковых инфекциях.
Пример некоторых дезинфектантов, которые фигурируют в инструкциях многих производителей для поверхностной дезинфекции датчиков.
|
Sagrosept Tissues |
Пропанол-1 45%, пропанол-2 28%, молочная кислота 0,3% |
Влажные салфетки |
|
Meliseptol HBV-Tucher |
пропанол (пропиловый спирт) 50,0±2,5%, дидецилдиметиламмоний хлорид - 0,075±0,004% (ЧАС) |
Влажные салфетки, спрей |
|
Incidin Liquid |
2-пропанол (35%), 1-пропанол (25%), амфотензид (0,375%), пропандиол (~1%) |
Влажные салфетки, спрей |
|
Salvanios pH 7 |
Дидецилметилполиэтоксиаммония пропионат 8.75 % (ЧАС), Полигексаметиленбигуанидин гидрохлорид 0.96 % (ЧАС), ПАВы |
Концентрированный раствор |
|
Sani-Cloth HB |
Алкилдиметилбензиламмоний хлорид (ЧАС) 0.07% Диоктилдиметиламмоний хлорид (ЧАС) 0.07% |
Влажные салфетки |
|
Tristel Trio |
|
Три типа влажных салфеток в комплекте |
Опять же из моего знания инструкций для подавляющего большинства датчиков для поверхностной дезинфекции подходят средства на основе изопропилового спирта в концентрации не более 60% и четвертичных аммониевых соединений (ЧАС). Дезсредства импортного производства бывают недоступны в РФ, бывают очень дорогие. Ниже некоторые отечественные аналоги (не является официальной рекомендацией!)
|
Наименование |
Действующее вещество |
Концентрация |
Форма |
|
Авансепт |
Пропанол-1 |
28 % |
Салфетки, Спрей |
|
Алкилдиметилбензиламмоний хлорид (ЧАС) |
0.02 % |
||
|
Полигексаметиленбигуанид гидрохлорид (ЧАС) |
0.04 % |
||
|
Бонацид |
Изопропиловый спирт |
60% |
Спрей |
|
Алкилдиметилбензиламмоний хлорид (ЧАС) |
0,1% |
||
|
Диаспрей |
Изопропиловый спирт |
30% |
Спрей |
|
Полигексаметиленбигуанид гидрохлорид (ЧАС) |
0,25% |
||
|
Дидецилметиламмоний хлорид (ЧАС) |
0,1% |
||
|
Лизаксин |
Изопропиловый спирт |
17,2% |
Салфетки, спрей |
|
Диизобутилфеноксиалкилбензилхлорид аммония (ЧАС) |
0,28% |
||
|
Миродез |
Дидецилметиламмоний хлорид (ЧАС) |
Смесь ЧАС 0.65 % |
Салфетки, спрей |
|
Диоктилдиметиламмоний хлорид (ЧАС) |
|||
|
Алкилдиметилбензиламмоний хлорид (ЧАС) |
|||
|
Октилдецилдиметиламмоний хлорид (ЧАС) |
|||
|
Трилокс |
Пропанол-1 |
26,0 ± 2,0% |
Салфетки, спрей |
|
Смесь ЧАС |
0.065% |
||
|
Тетрамин |
алкилдиметилбензиламмоний хлорид (ЧАС) |
13% |
Жидкость Раствор 0.5-2%, погружение 10-45 мин |
|
дидецилдиметиламмоний хлорид (ЧАС) |
1,4% |
||
|
полигексаметиленгуанидин гидрохлорид (ЧАС) |
5% |
||
|
N,N-бис(3-аминопропил)додециламин (ЧАС) |
4% |
Некоторые производители не разрешают протирать кабели дезсредствами на основе изопропилового спирта. Не стоит использовать салфетки в состав которых входят различные добавки типа ароматических, смягчающих кремов и т.п.
Большинство производителей не разрешает использовать этиловый спирт для дезинфекции. Опять же не прикладывайте избыточного усилия при протирке датчика, в целом обращайтесь с датчиком очень аккуратно. Протирка дез. салфеткой фактически совмещает в себе шаги 1 и 2 при поверхностной дезинфекции.
3) После обработки дезсредством датчик должен высохнуть на воздухе либо протереть насухо.
1) Очистка проводится аналогично п 1. при поверхностной дезинфекции
2) Все внутриполостные (вагинальные, ректальные) должны быть подвергнуты дезинфекции высокого (глубокого) уровня перед применением у каждого следующего пациента.
Для защиты пациента и специалиста УЗД все внутриполостные исследования должны выполняться в перчатках. При удалении датчика из полости пациента следите, чтобы на датчик не попали выделения пациента. Перчатки необходимы также для снятия презерватива и проведения очистки датчика, как описано выше. Повреждение целостности презерватива не требует изменения процедуры глубокой дезинфекции.
Глубокая дезинфекция как правило проводится путем замачивания датчика в разрешенный производителем дезраствор, на глубину, которая указана производителем УЗ аппаратуры, и на время, которое указано в инструкции.
Пример некоторых дезсредств, которые фигурируют в инструкциях многих производителей для глубокой дезинфекции датчиков:
|
Наименование |
Действующее вещество |
Форма |
|
Cidex |
Глютаровый альдегид (готовый раствор) |
Раствор + активирующий порошок |
|
Cidex |
Ортофталевый альдегид |
Раствор |
|
Anioxyde 1000 |
Перуксусная кислота |
Раствор |
|
Banicide Plus |
Глютаровый альдегид |
Раствор |
|
Omnicide 28 |
Глютаровый альдегид |
Раствор |
|
Perastel |
Перуксусная кислота |
Раствор |
Имейте ввиду большинство данных средств обладает едким запахом и раздражающим действием, требуется проводить обработку в перчатках и вентилируемом помещении. Готовый рабочий раствор как правило обладает ограниченным сроком годности (2 недели). Продолжительность замачивания от 10 мин и выше (см. инструкцию к конкретному препарату). Не рекомендуется, чтобы датчик упирался рабочей поверхностью в дно емкости.
Еще раз поводу «водоустойчивости» датчиков. У некоторых производителей можно замачивать датчик полностью и кабель (за исключением разъема), примерно так:
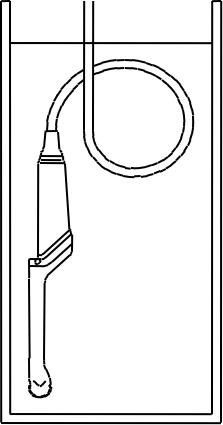
У некоторых производителей вот так:

Есть еще быстрый и удобный вариант глубокой дезинфекции датчиков – аппарат Trophon (на основе перекиси водорода). Проблемы: цена аппарата и расходных материалов, не все производители одобрили использование этого устройства для дезинфекции датчиков.
3) После глубокой дезинфекции необходимо ополоснуть датчик в чистой воде. После особо токсичных дезсредств (альдегиды) тщательно последовательно 3 раза сполоснуть в чистой воде в 3х разных емкостях. Насухо протереть мягкой тканью, мягким бумажным полотенцем.
Ни в коем случае не претендую на истину в последней инстанции!
Отлично понимаю, что суровая реальность нашей работы неизбежно вносит свои коррективы. Для того чтобы проводить глубокую дезинфекцию с замачиванием при потоке пациентов надо иметь несколько однотипных внутриполостных датчиков и медсестру в кабинете УЗИ…
Надеюсь вышеизложенное поможет коллегам понять ситуацию с обработкой датчиков. Даже очистка от геля и поверхностная дезинфекция датчика позволяет удалить подавляющее большинство патогенных микроорганизмов (6,7).
Читайте инструкции!
Комментариев еще нет
Если вы впервые на сайте, заполните, пожалуйста, регистрационную форму.
Кабанов Владимир Анатольевич
Сухоручкин Александр Александрович
Ковынев Александр Владимирович
Кабанов Владимир Анатольевич
Дмитриева Наталья Анатольевна
Некрасов Николай Анатольевич
Рутинская Анна Владимировна
Ковынев Александр Владимирович
Некрасов Николай Анатольевич
Ковынев Александр Владимирович
Рутинская Анна Владимировна
Ковынев Александр Владимирович
Ковынев Александр Владимирович
Рутинская Анна Владимировна
Рамазанов Назим Рамазанович
Антонов Валерий Николаевич
Ковынев Александр Владимирович
Ендальцева Ирина Александровна