Международное, общество ультразвуковой диагностики в акушерстве и гинекологии (The International Society of Ultrasound in Obstetrics and Gynecology (ISUOG)) является научной организацией, которая осуществляет и обеспечивает безопасное медицинское обслуживание, высококачественное преподавание и научно-исследовательскую работу в области диагностического воспроизведения изображения, необходимого в сфере здравоохранения женщины и предоставляемых в этой связи медицинских услуг.
Компетенцией Комитета по Клиническим Стандартам (CSC) Международного общества ультразвуковой диагностики в акушерстве и гинекологии (ISUOG) является разработка Практического Руководства и Общих Рекомендаций, которые обеспечивают практикующих врачей описанием современных подходов к диагностическому обследованию.
В них описываются методы, которые, по мнению ISUOG, являются наилучшими для практики, на момент издания. Не смотря на то, что ISUOG прилагает все усилия для соблюдения существующих на сегодня стандартов при разработке и составлении Руководства, ни Общество, ни кто-либо из его сотрудников или его членов не берет на себя ответственность за последствия любых неточных или вводящих в заблуждение данных, основанных на мнениях или положениях, изданных CSC (Комитетом по клиническим стандартам).
Документы CSC ISUOG не предназначены для установления правового стандарта медицинской помощи, потому что на интерпретацию доказательств, которые лежат в основе Руководства могут влиять индивидуальные факторы, локальные протоколы лечения и наличие ресурсов. Утвержденные Руководства могут свободно распространяться с разрешения ISUOG (info@isuog.org).
Этот документ представляет собой пересмотренный и обновленный вариант ранее опубликованного Руководства ISUOG для скрининга сердца в середине беременности [1] и отражает современные знания относительно пренатального обнаружения врожденных пороков развития сердца (ВПС). Согласно обновленным Рекомендациям ISUOG проекция выходных трактов (выход магистральных сосудов) и четырех камер сердца плода теперь являются частью рутинного исследования [2-5].
ВПС являются основной причиной младенческой смертности, с приблизительной заболеваемостью около 4-13 на 1000 новорожденных [6-8]. По данным Всемирной Организации Здравоохранения (ВОЗ) за период с 1950 года по 1994 42% младенческой смертности была связана с пороками сердца [9]. Пороки развития сердца являются, кроме этого, наиболее часто не диагностируемыми при УЗИ [10,11].
Пренатальная диагностика ВПС может улучшить дальнейший исход у плодов, с определенными типами патологий сердца [12-16]. К сожалению, пренатальный уровень диагностики является крайне вариабельным [17], что объясняется такими причинами, как уровень компетентности врача, высокий индекс массы тела беременной, тип используемого датчика, наличием рубцов на передней брюшной стенке, гестационным сроком, объемом околоплодных вод и положением плода [18,19].
Особенно важными факторами, которые могут улучшить эффективность программы скрининга являются: постоянная, на на основе обратной связи, подготовка специалистов, направление на экспертную эхокардиографию плода всех подозрительных случаев и возможность направления на консультацию к специалистам-кардиологам [8,20].
В качестве примера, частота обнаружения тяжелых пороков сердца увеличилась вдвое после реализации двухгодичной программы-тренинга в медицинском учреждении Северной Англии [21]. Скрининговое исследование сердца плода разработано для увеличения частоты выявлений сердечных патологий во время второго триместра беременности [22]. Эти принципы можно использовать при обследовании плодов с низким риском ВПС, как часть рутинного пренатального исследования.
Этот подход также полезен для выявления плодов с высоким риском генетических синдромов, а также как информация для консультирования пациентов, ведения беременности и обеспечения многопрофильного ухода. В случае подозрения на ВПС, требуется более всесторонняя, экспертная оценка с использованием эхокардиографии плода [26].
Несмотря на доказанную диагностическую ценность исследования срезов четырех камер сердца и выходных трактов (выход магистральных сосудов), каждый исследователь должен осознавать возможность диагностических ошибок, которые могут помешать своевременному выявлению ВПС.
Уровень обнаружения можно оптимизировать путем выполнения тщательных скрининговых обследований сердца, сознавая, что проекция четырех камер сердца - это гораздо большее, чем простой подсчет сердечных камер, учитывая, что есть такие типы патологии, обнаружить которые на ранних стадиях невозможно, и зная, что некоторые виды нарушений (например, транспозиция магистральных артерий или коарктация аорты) не могут быть обнаружены при исследовании только четырехкамерного среза сердца.
Важным шагом улучшения обнаружения ВПС при скрининговом обследовании является дополнение к четырехкамерному срезу проекций выходных трактов.
Оптимальное выполнение скринингового исследования сердца плода считается 18-22 недели беременности, хотя многие анатомические структуры могут визуализироваться только после 22 недели. Некоторые аномалии могут быть диагностированы в конце первого и начале второго триместра беременности, особенно когда производится исследование воротникового пространства [30-35].
Проведение скрининга на 20-22 неделе беременности предпочтительно, так как редко требует дополнительного сканирования для окончательной оценки, тем не менее, многие пациентки предпочли бы знать о серьезных дефектах на более раннем периоде беременности [36]
Высокочастотные датчики могут увеличить вероятность обнаружения мелких дефектов, но при этом не обладают глубоким акустическим проникновением (пенетрацией). При всех исследованиях следует использовать максимально возможную частоту датчика, добиваясь компромисса между пенетрацией и резолюцией. Визуализация при помощи гармоник (harmonic imaging) может обеспечить улучшенное изображение, особенно у полных пациенток во время третьего триместра беременности [37].
Серия поперечных срезов в серой шкале изображения по-прежнему является основным методом сканирования сердца плода. В системных настройках следует отметить высокую частоту кадров, с повышенной контрастностью и высоким разрешением. Следует также использовать низкую персистенцию (продолжительность), единственную акустическую фокусную зону и относительно узкий сектор изображения.
Изображение следует увеличивать, пока сердце не будет занимать, по крайней мере, от одной трети до половины экрана. Функция «кино-петли» должна дополнять исследование в реальном масштабе времени и обеспечивать более точную оценку состояния сердечных структур; например, для подтверждения движения створок клапанов во время всего сердечного цикла. Увеличение изображения и функция «кино-петли» могут помочь в обнаружении аномалий.
Учитывая время, прошедшее с момента публикации первых «методических рекомендации» ISUOG [1] и данные, взятые из новейших публикаций, скрининговое исследование сердца плода должно включать в себя как четырехкамерный срез, так и срезы выходных трактов (выход магистральных сосудов) [38-46].
В этом срезе необходимо тщательно оценить специфические критерии и не следует ограничиваться простым подсчетом камер сердца. Основные элементы, которые необходимо оценить в этом срезе представлены в таблице 1 и на рисунках 1 и 2. Для оценки позиции сердца необходимо сначала определить положение плода, то есть идентифицировать его правую и левую стороны, а потом определить левостороннее расположение желудка и сердца плода.
Сердце в норме занимает не больше одной трети всей области грудной клетки. В некоторых проекциях может визуализироваться гипоэхогенный ободок вокруг сердца плода, который ошибочно можно принять за перикардиальный выпот. Эта находка, если она изолированная, как правило, является нормой [47, 48].
Сердце по большей части располагается в левой стороне грудной клетки и его длинная ось в норме направлена влево под углом около 45+20 градусов (2 SD) [49] (Рисунок 1). Особое внимание следует уделять сердечной оси и ее расположению, которое легко оценить, даже если четырехкамерный срез не визуализируется должным образом [50].
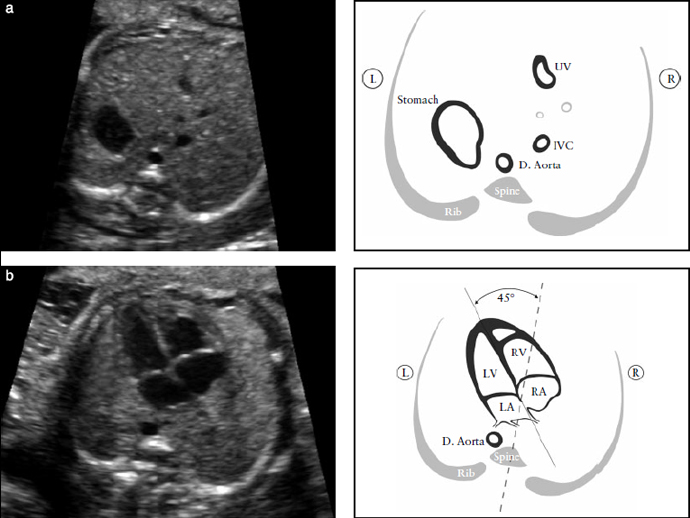
Рисунок 1. (А) Поперечный срез живота плода: определение ситуса. После определения положения плода в утробе матери необходимо идентифицировать желудок плода в левой стороне живота; там же, где видна нисходящая аорта (D. Aorta) - слева, и нижняя полая вена (IVC) - справа от позвоночника. Короткий сегмент пупочной вены (UV) также должен визуализироваться. (b) Направление оси сердца: сердце большей частью должно находиться в левой половине грудной клетки.
Верхушка сердца должна быть 45º по отношению к передне-задней оси грудной клетки. LA- левое предсердие, LV- левый желудочек; R- право; RA- правое предсердие; RV-правый желудочек.
Если сердце и/или желудок плода не определяются с левой стороны, то это подозрительно на аномалии расположения органов (ситуса) - situs abnormalities. Аномальная ось сердца увеличивает риск ВПС, особенно выходных трактов. Такая находка может так же ассоциироваться с хромосомными аномалиями.
Смещение сердца от его нормального левостороннего расположения может быть вызвано также диафрагмальной грыжей или объемным образованием, таким как кистозная аденоматозная мальформация легких. Нарушения положения сердца также могут быть вторичными при гипоплазии или агенезии легкого плода. Сдвиг оси сердца влево может также быть в следствие гастрошизиса или омфалоцеле.
Необходимо подтвердить нормальную частоту сердечных сокращений (ЧСС) и регулярный ритм сердцебиения плода. Нормальная ЧСС у плода колеблется от 120 до 160 ударов в минуту. Легкая транзиторная брадикардия во время второго триместра является нормальным наблюдением.
Стойкая брадикардия, особенно когда сердечный ритм постоянно менее 110 ударов в минуту [51], требует своевременной консультации кардиолога, из-за возможности сердечного блока. Повторные децелерации в третьем триместре могут быть вызваны гипоксией плода. Отдельные пропущенные удары сердца, как правило, не связаны с повышенным риском ВПР сердца плода, они обычно являются доброкачественными и спонтанно проходят.
Тем не менее, некоторые случаи с клинически выраженной аритмией являются показанием для эхокардиографии плода [52, 54]. Альтернативным ведением может быть использовании аускультации методом Допплера, а также целенаправленное сканирование плода для исключения патологических выпотов и подтверждения нормального строения сердца плода.
Легкая тахикардия (>160 ударов в минуту) может быть обычной реакцией плода во время его движения. При постоянной тахикардии (≥ 180 ударов в минуту) [55], необходимо более тщательное исследование для исключения гипоксии плода или патологической тахиаритмии. Оба предсердия в норме должны быть одинаковыми по размерам. Клапан овального отверстия должен открываться в левое предсердие. Нижний край межпредсердной перегородки, называемый первичной перегородкой (septum primum), должен быть визуализирован.
Эта структура является местом соединения стенок четырех камер сердца, где перегородка нижней части предсердий соединяется с перегородкой верхней части желудочков, и где прикрепляются створки атриовентрикулярных клапанов, формируя "крест" сердца (cardiac ‘crux’). Обычно можно увидеть как легочные вены впадают в левое предсердие.
При технической возможности, рекомендуется визуализация по крайней мере двух легочных вен. Модераторный пучок - это легко видимый мышечный пучок, который пересекает полость правого желудочка, и виден вблизи вершины желудочка. Он помогает морфологически отличить правый желудочек от левого. Верхушка левого желудочка выглядит более гладкой и образует верхушку сердца.
Оба желудочка должны быть одинаковыми по размерам и не иметь утолщенных стенок. Хотя легкая диспропорция желудочков может в норме наблюдаться в третьем триместре беременности, явная право-левосторонняя асимметрия в середине беременности требует дальнейшего обследования [56]. Серьезными причинами этой диспропорции являются левосторонние обструктивные пороки, такие как коарктация аорты и синдром гипоплазии левых отделов сердца [57,58]. Межжелудочковая перегородка должна быть тщательно осмотрена от вершины до места соединения стенок четырех камер сердца для исключения ее дефектов.
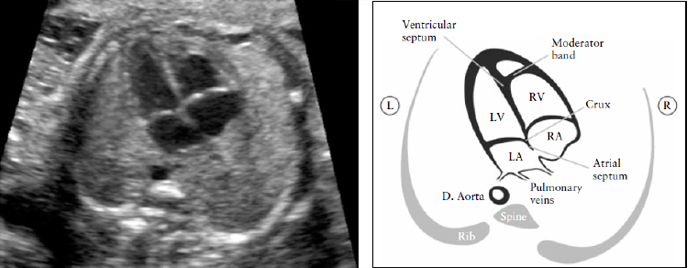
Рисунок 2. Четырех-камерный срез сердца. Ключевые элементы этого среза во втором триместре: сердце занимает не более 1/3 грудной клетки, правые и левые отделы сердца почти одинаковые по размеру (размер камер и толщина стенок), клапан овального окна открывается в левое предсердие, интактный " крест" сердца с нормальным смещением двух атриовентрикулярных клапанов и интактная межжелудочковая перегородка.
Морфологически правый желудочек идентифицируется наличием модераторного пучка и трикуспидальным клапаном, который располагается более апикально по отношению к митральному клапану. D. Aorta- нисходящая аорта ; L- левый; LV-левый желудочек; R- правый; RA- правое предсердие
Дефекты межжелудочковой перегородки (ДМЖП) могут быть сложно диагностируемыми. Перегородку лучше всего видно, когда угол инсонации перпендикулярен ей. Когда же ультразвуковой луч непосредственно параллелен стенке желудочка, дефект может быть ложно заподозрен по причине акустического артефакта.
Небольшие ДМЖП (1-2 мм) часто очень сложно верифицировать, когда ультразвуковой аппарат не обеспечивает достаточную степень разрешения, и особенно если расположение плода не является благоприятным. Однако, в большинстве случаев, они имеют ограниченное клиническое значение и даже могут спонтанно закрываться внутриутробно [59,60].
Два отдельных атриовентрикулярных клапана (правосторонний – трехстворчатый клапан; левосторонний – митральный клапан) должны визуализироваться свободно и самостоятельно двигающимися. Септальная створка трехстворчатого клапана прикреплена несколько ближе к верхушке по сравнению со створкой митрального клапана (т.е. нормальное смещение - offset). Аномальное прикрепление атриовентрикулярных клапанов может быть ключевой эхографической находкой для определения пороков сердца, таких как атриовентрикулярный септальный дефект (атриовентрикулярный канал).
Выведение срезов выходных трактов правого и левого желудочка считается неотъемлемой частью скринингового исследования сердца плода. Важно убедиться, что оба сосуда в нормальном состоянии, включая их соединение с соответствующими желудочками и их относительный размер; и проследить нормальное открытие клапанов какому-либо из параметров, рекомендовано дальнейшее более тщательное обследование.
Как минимум, обследование выходных трактов включает оценку следующих параметров: крупные сосуды должны быть примерно равны по размерам и, в месте выхода из соответствующих желудочков, пересекать друг друга под прямым углом (Приложение S1, Панель 1).
Было проведено масштабное исследование, включающее более 18000 плодов [61], в котором рутинное 30 минутное УЗИ по стандартной схеме включало исследование четырех камер сердца и, при технической возможности, оценку выходных трактов. В результате, в большинстве обследований (93%), когда было адекватное выведение четырех-камерного среза, можно было также удовлетворительно вывести и оценить срезы через выходные тракты.
Не удалось визуализировать срез в 4,2% для выходного тракта левого желудочка, 1,6% для правого и 1,3% для обоих выходных трактов. Дополнительные поперечные срезы дают возможность более тщательно оценить магистральные сосуды и другие окружающие их структуры. Они представляют собой непрерывную развертку, начиная с выходного тракта правого желудочка и включают проекции трех сосудов (3V) и трех сосудов и трахеи (3VT) (Приложение S1, План 2).
В проведенном исследовании с участием около 3000 беременных женщин низкого риска, которые были обследованы одним оператором, срезы через 3 сосуда (3V) и через 3 сосуда и трахею (3VT) были добавлены к стандартной проекции четырех камер как часть рутинного скрининга.
В среднем, требовалось чуть больше двух минут, чтобы получить необходимые срезы сердца (135 сек, SD, 20 сек), но примерно в одной трети случаев УЗИ, исследование приходилось откладывать на 15-20 минут в связи с неблагоприятным положением плода (когда позвоночник плода находится кпереди) [46].
Вероятность обнаружить большинство ВПС будет выше, если кроме проекции четырех камер сердца, оценивать также и выходные тракты [20,40,42,62,63]. Включение в рутинное обследование сердца срезов выходных трактов дает возможность обнаружить аномалии конотрункуса, такие как тетрада Фалло, транспозиция главных артерий, двойной выход сосудов из правого желудочка и общий артериальный ствол [43-46,64-69].
Выполнение поперечной развертки (transverse sweep - sweep technique) проводится с помощью продвижения датчика от животика к головке плода (на уровне стандартного измерения окружности живота) через проекцию четырех камер сердца по направлению к средостению.
Эта техника дает возможность комплексного обследования сердца плода и предоставляет различные проекции, посредством которых можно оценить нормальное строение выходных трактов: проекций выходного тракта левого и правого желудочка, проекции трех сосудов и проекции трех сосудов и трахеи [70] (Рисунок 3).
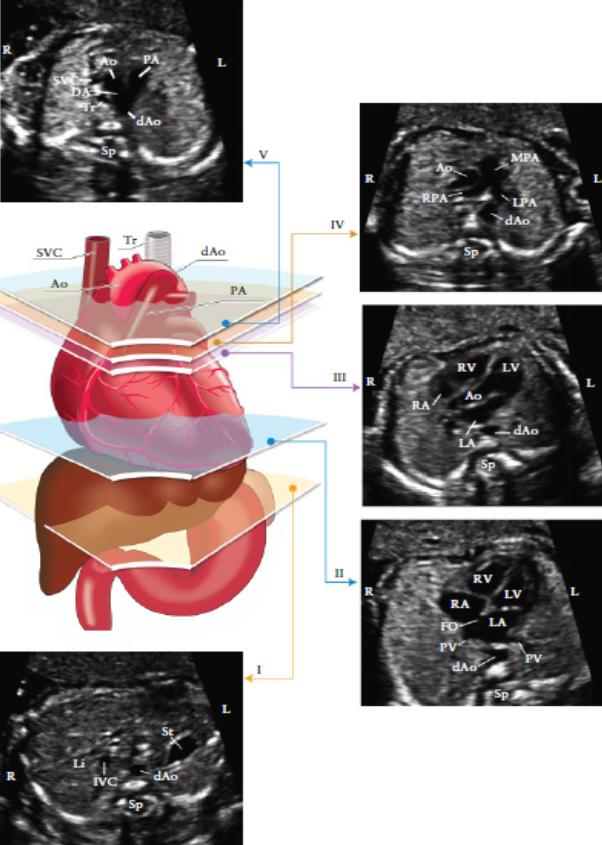
Рисунок 3. Пять поперечных срезов для оптимального сканирования сердца плода. На цветном изображении представлены: трахея (Tr), сердце и магистральные сосуды, печень и желудок, с пятью срезами в серо- шкальном режиме, обозначенными соответствующими многоугольниками.
(I) наиболее каудальный срез, на котором представлены желудок (st), поперечный срез нисходящей аорты (d Ao), позвоночник (Sp), печень (Li). (II) четырехкамерный срез сердца, представленных правым желудочком и левым желудочком(RV, LV) и предсердиями (RA, LA), овальное окно (FO), легочные вены ( PV) справа и слева от dAo. (III) Выходной тракт левого желудочка: ствол аорты (Ao), LV, RV,LA, RA и поперечное сечениеАо. (IV). Немного сместив датчик к головке плода (выходной тракт правого желудочка) выявляется главный ствол легочной артерии (MPA), бифуркация на правую (PPA) и левую (LPA) легочные артерии и поперечное сечение восходящей аорты (Ао) и dAo. (V) трехсосудистый срез и трахея, демонстрирует верхнюю полую вену (SVC), пульмональную артерию (РА), артериальный проток (DA), поперечный срез дуги аорты (от проксимальной Ао к dAo) и трахею (Tr). IVC-нижняя полая вена, L- лево, R- право. Модифицировано с разрешения Yagel et al. [70]
В идеальном случае, все проекции выходных трактов визуализируются относительно легко. Тем не менее, не у всех пациентов при рутинном УЗИ возможна визуализация вышеописанных срезов. Проекции выходного тракта левого и правого желудочков можно получить сдвинув (или наклонив под углом) датчик к головке плода (рисунок 4), начиная с проекции четырех камер сердца и до получения нормального поперечного среза аорты и главной легочной артерии и места их отхождения. Также можно выявить бифуркацию легочной артерии (Приложение S1, Планы 1 и 2).

Рисунок 4. Техника сканирования сердца плода. Четырехкамерный вид получается при проведении серии поперечных срезов вдоль грудной клетки плода. Направление датчика под углом к головке плода из четырехкамерного среза дает последовательно визуализацию выходных трактов: LVOT- левый выходной тракт, RVOT- правый выходной тракт; 3V- срез через три сосуда и 3VT-срез через три сосуда и трахею.
Были описаны и другие способы оценки выходных трактов: ротационная техника [41] (Приложение S2, План 1). Из проекции четырех камер сердца сначала датчик должен быть развернут к правому плечу плода. Эта техника выполняется легче, когда межжелудочковая перегородка перпендикулярна по отношению к ультразвуковому лучу.
Она требует немного больше УЗ навыков, но обеспечивает оптимальную визуализацию выходного тракта левого желудочка, и особенно целостность выхода аорты и межжелудочковой перегородки. Это также позволяет визуализировать всю восходящую аорту, в отличие от методики развертки, когда удается визуализировать только проксимальную часть аорты.
При использовании обеих методик, после выведения проекции выходного тракта левого желудочка, датчик поворачивается по направлению к головке плода, пока не выявляется легочная артерия, которая будет почти перпендикулярной по отношению к аорте. Дополнительные проекции аорты и легочной артерии можно получить путем дальнейшего продвижения или наклона датчика к головке плода от выходного тракта правого желудочка.
Эти срезы соответствуют проекциям трех сосудов и трех сосудов и трахеи, в которых можно оценить взаимоотношение двух артерий с верхней полой веной и трахеей. В этих плоскостях также могут визуализироваться как дуга артериального протока, так и поперечная дуга аорты (64-67).
Проекция выходного тракта левого желудочка подтверждает выход магистрального сосуда (аорты) из морфологически левого желудочка (рисунок 5). Необходимо проследить непрерывность перехода межжелудочковой перегородки в переднюю стенку аорты.
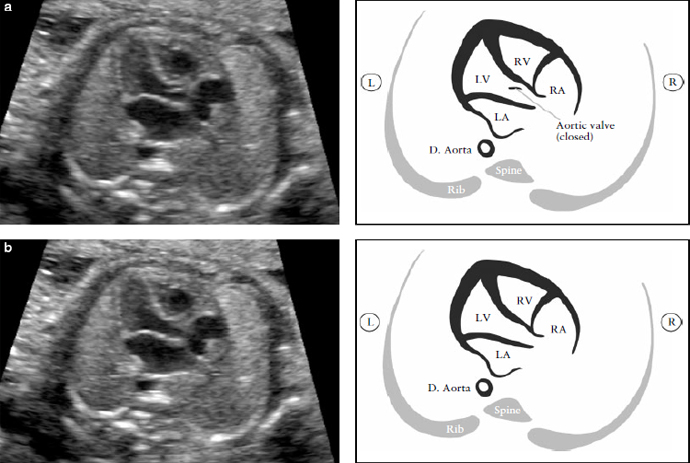
Рисунок 5. Выходной тракт левого желудочка (LVOT). Этот срез демонстрирует соединение сосуда с левым желудочком (LV). Крайне важно увидеть отношение между межжелудочковой перегородкой и передней стенкой этого сосуда, который в норме является аортой. Аортальный клапан не должен быть утолщен и должен свободно открываться. Аортальный клапан закрыт (а) и открыт (b). D aorta- нисходящая аорта; L-левый; LA - левое предсердие; R- правый; RA-правое предсердие; RV- правый желудочек.
Клапан аорты должен свободно двигаться и не иметь утолщений. Возможно проследить переход аорты в дугу, из которой три артерии ответвляются к шее. Однако выявление этих сосудов из дуги аорты не является частью рутинного исследования сердца. Проекция выходного тракта левого желудочка помогает определить выходные дефекты межжелудочковой перегородки и пороки конотрункуса, которые не видны при исследовании одного только четырех-камерного среза сердца.
Проекция выходного тракта правого желудочка подтверждает выход магистрального сосуда (легочной артерии) из морфологически правого желудочка (Рисунок 6). В норме легочная артерия выходит из правого желудочка и направляется влево и несколько кпереди от восходящей аорты.
Как правило, во время внутриутробной жизни плода, легочная артерия немного больше по размерам, чем аорта и пересекает восходящую аорту почти под прямым углом чуть выше места ее выхода. В этой плоскости, как показано на рисунке 6, верхнюю полую вену часто можно увидеть справа от аорты.
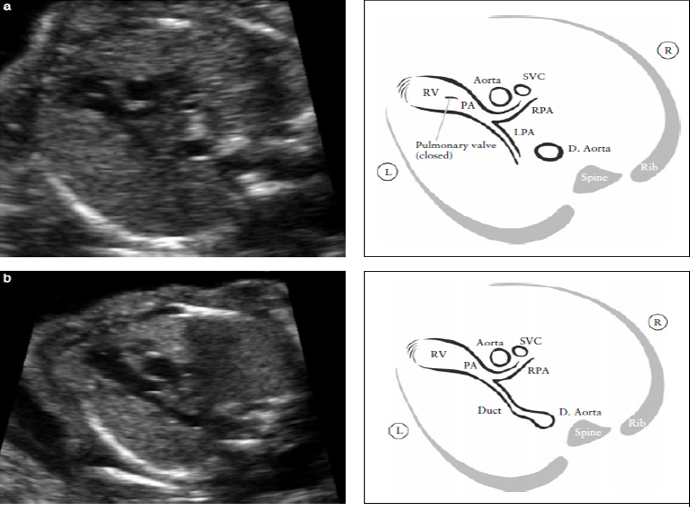
Рисунок 6. Выходной тракт правого желудочка. Этот срез демонстрирует соединение между сосудом и правым желудочком. (RV). В нормальном сердце этот сосуд пересекает аорту, что помогает идентифицировать его как легочную артерию (PA). Клапан легочной артерии не должен быть утолщен и должен свободно открываться. Рисунок (а) демонстрирует бифуркацию легочной артерии на две ее ветви. Легочный клапан закрыт.
Рисунок (b) демонстрирует срез при продвижении датчика в сторону головки плода. На нем видны: PA- легочная артерия, RPA- правая ветвь легочной артерии и артериальный проток. D. Aorta- нисходящая аорта, L- левый, LPA- левая ветвь легочной артерии, R- правый, SVC- верхняя полая вена.
Эта проекция представляет собой срез через три сосуда, описанный Yoo et al [64]. Клапан легочной артерии должен двигаться свободно и не иметь уплотнений. Если сосуд, отходящий от правого желудочка, почти сразу разветвляется (бифуркация), значит это - легочная артерия.
Сначала отходит правая ветвь легочной артерии, а затем отходит и левая ветвь. Из-за положения плода это разделение не всегда можно увидеть. В норме, легочная артерия продолжается дистально по левой стороне вплоть до артериального протока, который потом соединяется с нисходящей аортой (Рисунок 6 и Приложение S1).
Визуализация проекции трех сосудов и трех сосудов с трахеей очень желательна. Попытка ее проведения должна быть сделана в рамках скринингового обследования сердца, хотя технически не всегда возможно получить этот срез у всех пациенток. Эти две стандартные ультразвуковые проекции определяют три сосудистые структуры, их взаимоотношения относительно друг друга и дыхательных путей (трахеи).
Yoo et al [64] описали проекцию трех сосудов для оценки состояния легочной артерии, восходящей аорты и верхней полой вены и определения их относительных размеров и взаимоотношения (Рисунок 7). В целом, необходимо определить количество сосудов, измерить их размер и оценить их взаиморасположение и ход. Сосуды, если смотреть слева направо, представляют собой: легочную артерию, аорту и верхнюю полую вену.
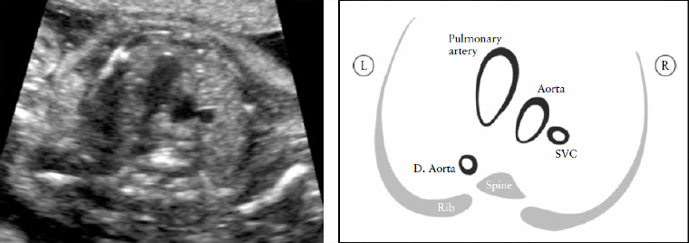
Рисунок 7. Срез через три сосуда (3V). Это срез наилучшим образом демонстрирует соотношение в верхнем средостении между легочной артерией, аортой и верхней полой веной (SVC). Очень важно оценить размер этих сосудов, их расположение и совпадение их осей. Легочная артерия слева; она наибольшая среди этих сосудов и расположена более кпереди, верхняя полая вена наименьший сосуд и расположена наиболее сзади. D. Aorta, нисходящая аорта.
Легочная артерия располагается наиболее спереди, а верхняя полая вена расположена наиболее сзади. Их относительный диаметр уменьшается слева направо: легочная артерия больше, чем аорта, но аорта больше, чем верхняя полая вена. Как правило, некоторые пороки сердца, с нормальным четырехкамерным срезом сердца (например: транспозиция магистральных артерий, тетрада Фалло и легочная атрезия с ДМЖП) скорее всего будут иметь нарушения в проекции трех сосудов. Yagel et al [67] впоследствии описали проекцию трех сосудов и трахеи, которая является более краниальным срезом.
В этой проекции поперечная дуга аорты лучше видна («срез дуги аорты»), а также акцентируется ее взаиморасположение по отношению к трахее. Обычно трахея идентифицируется, как гиперэхогенное кольцо, окружающее маленькое жидкостное пространство. Дуга артериального протока и дуга аорты расположены слева от трахеи и образуют V-образную форму, так как обе они сливаются в нисходящую аорту (Рисунок 8). Дуга аорты является более краниальной, чем дуга артериального протока, поэтому для одновременной визуализации обеих дуг, потребуются некоторое отклонение датчика от плоскости, параллельной проекции четырех камер.
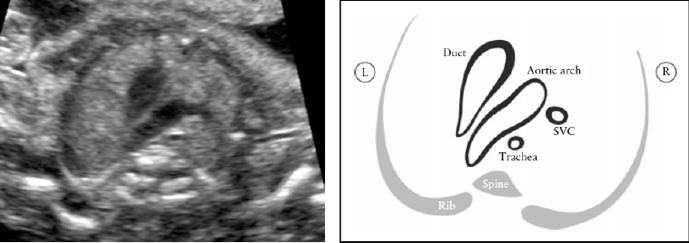
Рисунок 8. Срез через три сосуда и трахею (3VT). Этот срез демонстрирует наилучшим образом взаиморасположение дуги аорты по отношению к трахее. В нормальном сердце дуга аорты и дуга артериального протока располагаются слева от трахеи, образуя так называемое "V"- соединение. L-левый, R-правый; SVC-верхняя полая вена.
Проекция трех сосудов и трахеи дает возможность обнаружить такие пороки развития сердца как коарктация аорты, правосторонняя дуга аорты, удвоение дуги аорты и образование сосудистого кольца.
Хотя применение цветового допплеровского картирования (ЦДК) не считается обязательным в данной Рекомендации, мы призываем всех специалистов УЗИ ознакомиться с порядком его проведения и использовать его при рутинном скрининговом исследовании сердца [71]. ЦДК является неотъемлемой частью эхокардиографии плода и его роль в диагностике ВПС нельзя недооценивать.
ЦДК можно использовать во время рутинного скрининга сердца, если врач компетентен в его использовании. ЦДК может облегчить визуализацию различных структур сердца, а также поможет выявить аномалии кровотока. ЦДК также может представлять собой ценный инструмент в оценке пороков сердца у пациенток с высоким индексом массы тела [72], и может улучшить выявление тяжелых ВПС в группе беременных низкого риска [46,73].
Оптимальные настройки ЦДК для выявления кровотока через клапаны и сосуды включают в себя: использование узкого цветового окна (зоны интереса) - это повышает частоту кадров; правильную коррекцию частоты повторения импульсов (PRF), низкую персистенцию и адекватное усиление (смотрите Приложение S2).
Эхокардиографию плода обязательно проводить в следующих случаях: при подозрении на врожденный порок сердца (ВПС) плода, когда при скрининговом УЗИ невозможно получить проекцию четырех камер сердца и/или выходных трактов, или в случае, когда существуют факторы риска, указывающие на повышенную вероятность развития ВПС.
Детальное описание этой процедуры не входит в рамки данной статьи и было опубликовано ранее [26]. Большинство ВПС, которые можно обнаружить внутриутробно, возникает у беременных без какого-либо особого фактора риска или экстракардиальной патологии, поэтому скрининговое обследование является чрезвычайно важным.
Однако, медицинские работники должны знать некоторые показания для направления беременных женщин на всестороннее кардиологическое обследование плода. Например, увеличение толщины воротникового пространства (ТВП) более 3,5 мм в сроке 11-14 недель является показанием для более детальной оценки сердца, даже если при последующих УЗИ измерение этого же ТВП попадает в диапазон нормы [75-78].
Эхокардиография плода должна выполняться специалистами, которые компетентны в пренатальной диагностике ВПС. В дополнение к информации, получаемой при основном скрининговом УЗИ, подробный анализ структур сердца и их функции включает углубленную характеристику: висцеро- атриального расположения, системных и легочных венозные соединений, функции овального окна, атриовентрикулярных соединений, вентрикуло-артериальные соединений, взаимоотношения магистральных сосудов, сагиттального среза дуги аорты и дуги артериального протока.
Также, для изучения сердца плода используются и другие, обычные эхографические методы. Например, допплерометрия поможет измерять скорость кровотока в сосудах или определить аномальные потоки крови через клапаны и в камерах сердца. Эхокардиография в М-режиме также является важным методом анализа сердечного ритма, функций желудочков и определения толщины стенки миокарда.
Инновационные методы исследования сердца плода, такие как: тканевая допплерография и объемное УЗИ (3Д/4Д/пространственно- временная корреляция изображения (spatiotemporal image correlation = STIC)), становятся все более доступными. Их тоже можно использовать при исследовании анатомии и функции сердца плода. 4Д эхокардиография может быть полезной в случаях комплексных пороков развития сердца, включая пороки развития конотрункуса, аномалии дуги аорты и аномальный ход легочных вен [79-81]. Дополнительные методы УЗИ такие как, отслеживание движения точек (speckletracking), в данный момент, используются только в научных исследованиях, но в будущем могут стать важным клиническим инструментом в оценке функции сердца плода.
| Расположение и основные аспекты |
Определение правой и левой сторон плода Желудок и сердце находятся слева Сердце занимает 1/3 грудной клетки Большая часть сердца находится слева Ось сердца направлена влево 45 градусов +20 Определяются четыре камеры Нормальный сердечный ритм Нет перикардиального выпота |
| Камеры предсердий |
Два предсердия, примерно одинаковые по Клапан овального отверстия открывается в Первичная перегородка предсердий является Пульмональные вены входят в левое |
| Камеры желудочков |
Два желудочка, примерно одинаковые по Отсуствие гипертрофии стенок желудочков Модераторный пучок находится у верхушки Интактная межжелудочковая перегородка (от |
| Атриовентрикулярное соединение и клапаны |
Интактный 'крест' сердца Два атривенрикулярных клапана открываются Дифференциальное смещение (offsetting): |
Скачать рекомендации в формате .pdf
Опубликовано в Wiley Online Library
 934
934
Если вы впервые на сайте, заполните, пожалуйста, регистрационную форму.